La Química es parte de la Ciencia que estudia la obtención, las propiedades y la transformación de las Sustancias Puras y los sistemas que ellas forman.
La Ciencia es el conocimiento obtenido a través del llamado método científico.
Las Sustancias Puras son una manifestación más o menos sofisticada de la materia y la comprensión del concepto se alcanza luego de un estudio breve de los diferentes sistemas materiales. La materia es todo lo que tiene masa o pesa y puede ser perceptible o imperceptible por nuestros sentidos.
El aspecto estructural fundamental es el carácter discontinuo, corpuscular o particulado de la materia que se manifiesta en fenómenos de difusión y cambios de estado físico.

Modelo Estructural Molecular de las Sustancias Puras
1 .- Un cierto tipo de partículas, llamadas moléculas, invisibles y que poseen cualidades que veremos a continuación, nos permiten comprender el concepto de Sustancia Pura.
2.- Una Sustancia Pura es un conjunto de moléculas idénticas, de igual tamaño, masa, y forma.
Ejemplos:

3.- Las moléculas tienen la cualidad del movimiento, poseen Energía Cinética que es proporcional a la temperatura y además se atraen entre sí mediante fuerzas de atracción intermoleculares que son de naturaleza eléctrica..


Las Sustancias Puras y las propiedades
Los cambios de tipo físico de una sustancia pura nos muestran la necesidad de considerar el aspecto propiedades de los sistemas materiales. Esto es, si bién se trata del mismo tipo de moléculas , las propiedades (color, densidad, viscosidad, temperatura, etc. ) del sólido difieren de las del líquido y éste de las del gas.
El aspecto propiedades de los sistemas materiales se enfrenta con el concepto de Fase.
Una Fase es una porción de materia que posee idénticas propiedades, tanto físicas como químicas, en toda su extensión. En consecuencia los cambios de estado físico son cambios de Fase. Entonces una Sustancia Pura puede ser una fase sólida o una fase líquida o una fase gaseosa dependiendo de la temperatura a la que se encuentre. Durante el cambio de estado coexisten dos fases a la temperatura de la transición correspondiente.
A una determinada presión y a una determinada temperatura, una Sustancia Pura puede presentar coexistencia (existencia simultánea) de tres fases como representa el gráfico a continuación.


ANALISIS DE SISTEMAS HETEROGENEOS
Analizar un sistema heterogéneo significa separar las diferentes fases que lo conforman.
TECNICAS DE SEPARACIÓN DE FASES DE SISTEMAS HETEROGENEOS
FILTRACIÓN
FILTRACIÓN SIMPLE
FILTRACION CON SUCCIÓN O DE VACÍO
DECANTACION
CENTRIFUGACIÓN
SUBLIMACIÓN
DISOLUCIÓN
TAMIZACIÓN
No es una técnica de carácter sistemático, y tendría utilidad cuando el tamaño de grano del material particulado fuese significativamente diferente para cada una de las fases ( separación de arena de rio y harina ).
EJEMPLOS DE SISTEMAS HOMOGENEOS
1 Fase
Si observamos las fases líquidas del anterior ejemplo de sistemas homogéneos observamos una diferencia en cuanto al tipo de partículas que forman tales sistemas. De aquí aparece la necesidad de establecer otras categorías de sistemas materiales, esta vez respecto al número de tipos de partículas que forman el sistema.
EJEMPLOS DE SOLUCIONES
Las soluciones sólidas las encontramos en sistemas más conocidos como aleaciones ( bronce, aleación de cobre y estaño). La salmuera ( agua con sal común) es líquida y el aire (Oxígeno, Nitrógeno etc..) es gaseosa.
Los cambios de Estado Físico de las Soluciones también ocurren por variación de la temperatura. Los valores de las temperaturas de transición no son fijos como en las Sustancias Puras, sino que dependen de la proporción en que se encuentren los distintos tipos de moléculas.
ANALISIS DE SISTEMAS HOMOGENEOS
Analizar un sistema homogéneo significa separar las diferentes Sustancias Puras o tipo de moléculas que lo conforman.
TECNICAS DE SEPARACIÓN DE SUSTANCIAS PURAS DESDE SISTEMAS HOMOGENEOS
DESTILACIÓN
Rotavapor .
El Rotavapor permite la destilación a presión reducida o ligero vacío, de esta forma se logra una disminución de la temperatura de ebullición del solvente. Esta modalidad es conveniente cuando se desea evitar que los solutos de origen biológico se "desnaturalicen " o deterioren por excesivo calentamiento.
EXTRACCIÓN POR SOLVENTE
El soluto es extraído del solvente original por un solvente extractor, inmiscuible con el primero, y que disuelve mejor al soluto
CRISTALIZACIÓN
CONCEPTO PREVIO DE SOLUBILIDAD
La Solubilidad es la mayor cantidad de soluto, que en forma estable, se puede disolver en una determinada cantidad de solvente a una temperatura y presión dadas. Cuando la solución tiene disuelto la cantidad de soluto que corresponde a la solubilidad se dice que la solución está saturada
La Solubilidad de los sólidos en líquidos por lo general aumenta cuando aumenta la Temperatura.
En la cristalización se lleva a la solución a la condición de saturación a una temperatura alta, luego se deja enfriar lentamente y como la solubilidad es menor a menores temperaturas se forman cristales.
Los cristales se forman a partir de pequeños "nucleos de cristalización" ( formados por siembra de pequeños cristales, aristas de vidrio de los vasos o bien espontáneamente). Mientras menor cantidad de nucleos de cristalización se formen, mejores y mayores cristales se obtienen. Mientras más grande sea el cristal formado , la sustancia es más pura o menos contaminada con impurezas.
CROMATOGRAFÍA
Las diferentes Sustancias Puras de una mezcla se pueden separar por Cromatografía. Una muestra ( mezcla de moléculas coloreadas azul y rojo en el siguiente gráfico) se siembra en un soporte fijo o estacionario. El flujo de una fase movil arrastra de diferente manera ( separa ) los distintos tipos de moléculas.
Las moléculas son retenidas por la fase estacionaria mediante fuerzas de retención y al mismo tiempo son arrastradas por la fase movil mediante fuerzas de arrastre. La intensidad de estas fuerzas ( de naturaleza eléctrica ) son propias de cada sustancia. Si una sustancia es pobremente retenida pero fuertemente arrastrada tendrá un bajo tiempo de elución en cambio otra que es fuertemente retenida y pobremente arrastrada demorará mucho en cruzar la fase estacionaria y tendrá un tiempo de elución elevado.
El tiempo de elución para una determinada sustancia es constante para una fase estacionaria, fase movil, flujo y largo de columna determinados y es por lo tanto un factor de identificación de las sustancias.
Cromatografía líquida de capa fina.
Fué la primera en desarrollarse, las diferentes sustancias separadas eran reconocidas mediante reactivos que daban coloraciones particulares. De allí el nombre del método ( Chromos = Color ). Tiene utilidad de reconocimiento de diferentes Sustancias
Cromatografía líquida en columna
Usada con fines preparativos ( separar cantidades significativas de diferentes sustancias). La fase movil (líquido) desciende por gravedad. Es común detectar el descenso de las sustancias alumbrando el sistema con luz UV (ultravioleta)
Registro de Cromatografía de Gases
La fase estacionaria rellena un serpentín. Se hace fluir un gas como fase móvil en forma constante a presión constante. Se mide el tiempo de elución de la fase móvil y con el se comparan los tiempos de elución de las diferentes sustancias. Las sustancias son detectadas por métodos acoplados a sistemas electrónicos. Estos identifican y cuantifican los componentes del sistema mediante los correspondientes registros.
La cromatografía HPLC (High Performance Liquid Chromatography) además de identificar y cuantificar sirve a propósitos preparativos. En estos es sistemas es posible trabajar con fases moviles, mezclas de solventes, con gradientes programados de composición..
HIPOTESIS O PRINCIPIO DE AVOGADRO


Amadeus Avogadro En volumenes iguales, de cualquier gas, medidos en iguales
condiciones de P y T existe igual número de moléculas.
La Presión que ejercen las moléculas al chocar con las paredes del recipiente depende:
1) de la magnitud de los Impactos = masa x velocidad
(relacionable con la Energía Cinética = 1/2 masa x velocidad 2 y proporcional a la temperatura)
2) del número de Impactos ( proporcional al número de moléculas)
Avogadro razona:
Si las temperaturas son iguales, las magnitudes de los impactos son iguales (m v = m’v’, la molécula liviana se mueve rápido y la pesada se mueve lento) y si las presiones son iguales, el número de Impactos ( número de moléculas) son iguales.
Aplicando el Principio de Avogadro recién enunciado a lo observado por Gay Lussac según los ejemplos ya entregados se concluye que los volumenes de reaccionantes y productos observados se explican mediante las siguientes proposiciones de reordenamientos:
2 H 2 + O 2 = 2 H 2 O
N 2 + 3 H 2 = 2 NH 3
H 2 + Cl 2 = 2 H Cl
La Hipótesis de Avogadro no sólo explica los experimentos de Gay Lussac y permite conocer la fórmula de las moléculas de gases simples, sino que permite, pesando volumenes iguales de diferentes gases medidos en iguales condiciones de P y T donde hay igual número de átomos, establecer la primera relación de masas de los diferentes átomos.
Primeras escalas de Pesos Atómicos o Pesos relativos.
Estos pesos permitieron las relaciones de la Ley de las Proporciones Recíprocas, que junto a otras reglas, permitieron conocer la masa relativa de otros átomos como los de elementos metálicos.
Avogadro, cuando presentó su hipótesis en 1811, era un joven desconocido y su aporte no fue reconocido sino hasta el 1858 cuando la fuerza de lo verdadero se impuso. Medio siglo de masiva dependencia intelectual y carencia de espíritu crítico, situación incomprensible e inaceptable entre quienes se supone hacen la Ciencia.
2ªunidad -ESTUDIO DE LOS ATOMOS
La materia y la Electricidad
Diferentes experimentos demuestran la existencia de dos tipos de electricidad, se les denomina la positiva y la negativa. Si dos cuerpos poseen igual tipo de carga se repelen en tanto que si tienen cargas de distinto signo se atraen.

En sus experimentos de electrólisis, Faraday determinó la proporcionalidad entre la cantidad de sustancias transformadas y la cantidad de electricidad empleada. Surge la noción que la corriente eléctrica es un flujo de partículas que se les llamó electrones.

Tubo de rayos catódicos
Los electrones resultan ser partículas de carga eléctrica negativa cuya razón:
Carga
_________________ = 1,76 . 10 8 (Coulomb / gramo)
Masa
Millikan determina la carga eléctrica del electrón en su clásico experimento de la gota de aceite.

Así la carga del electrón se establece en 1,6 . 10 -19 coulomb y su masa en 9,1. 10 –28 gramos.
LAS PARTICULAS INTRATOMICAS FUNDAMENTALES
Rutherford, bombardea una lámina de oro, con rayos ( partículas "pesadas", cargadas positivamente)
Dispersión de los rayos por lámina de oro
Rutherford concluye que la lámina de oro es prácticamente vacía, o mejor, el átomo de oro concentra toda su masa en un núcleo de carga positiva de volumen muy pequeño en relación al volumen atómico total.
Comprende la presencia en el núcleo del átomo, de los protones, partículas cargadas positivamente y de masa mayor que la del electrón y que ya habían sido detectadas con el tubo de Thompson. También se comprende la presencia en el nucleo de los neutrones, partículas de igual masa que el protón pero sin carga eléctrica.
El nucleo, por la presencia de los protones, tiene carga positiva y por esta razón atrae los electrones (cargas negativas) que giran a su alrededor en órbitas semejantes, en una primera aproximación a las órbitas planetarias del sistema solar.

NOMENCLATURA PARA SISTEMAS ATOMICOS Y SUS MODIFICACIONES.
NUMERO MÁSICO CARGA ELÉCTRICA O ESTADO DE OXIDACIÓN A CARGA
SÍMBOLO S
NÚMERO ATÓMICO ATOMICIDAD Z X
DEFINICIONES
NÚMERO ATÓMICO = NÚMERO DE PROTONES = Z
NÚMERO MÁSICO = NÚMERO DE PROTONES + NÚMERO DE NEUTRONES = A
CARGA ELECTRICA = NÚMERO DE PROTONES - NÚMERO DE ELECTRONES
7 0 ión positivo
Ión : Atomo o grupo de atomos cargados eléctricamente.
ALGUNOS ELEMENTOS, SUS ATOMOS Y ALGUNOS DE SUS ISOTOPOS
Isótopos son átomos de igual Z pero distinto A.
Isobaros son átomos de distinto Z pero igual A
1 unidad de masa atómica, 1 (u.m.a.), equivale a 1/12 de la masa del átomo de 12C.
1 unidad de masa atómica prácticamente coincide con la masa de un protón o de un neutrón.
1 (u.m.a.) = 1, 67 . 10 - 24 ( g ).
DETERMINACIÓN DE LOS PESOS ATOMICOS O PESOS RELATIVOS
La existencia de isótopos (átomos de distinta masa) en todos los elementos debe ser tomada en cuenta cuando se trata de determinar las relaciones de los pesos de los átomos. En la actualidad es posible conocer los distintos tipos de isótopos que presenta un elemento en su estado natural y además es posible saber en que proporción o cantidad se encuentran gracias a la tecnología del espectrógrafo de masas.
Espectrógrafo de masas
El espectrógrafo de masas es un aparato en que por descargas eléctricas los átomos de un elemento se transforman en iones positivos. Estos iones son conducidos a la forma de un haz lineal hasta una zona en que son desviados mediante dispositivos magnéticos o eléctricos de acuerdo a la masa del ión ( los iones más pesados se desvían menos ). Así los iones en diferentes haces según su masa son detectados y cuantificados.
El Peso Atómico relativo se calcula de la siguiente manera:
A r = A1 * X1 + A2 * X2 + .............
Donde los A i son los Números Másicos o bién la masa en Unidades de Masa Atómica ( u.m.a.) de los distintos Isótopos y los X = % abundancia / 100
Ejemplo de cálculo del Peso Atómico
El Neón tiene dos isótopos.
El 20 Ne que tiene una masa de 19,992 u.m.a. y el 22Ne que tiene una masa de 21,991 u.m.a.
Por cada 100 atomos de la muestra natural 90 corresponden al 20Ne y 10 al 22 Ne, es decir, sus abundancias relativas son de 90% y 10% respectivamente.
El cálculo del Peso Atómico será:
PA Ne = 0.90 * ( 19,992 u.m.a.) + 0,10 * ( 21,991 u.m.a.) = 20 , 192 u.m.a.
3ª UNIDAD-ENVOLTURA DE LOS ATOMOS
La determinación de la disposición de los electrones alrededor del nucleo atómico ha sido un inmenso logro de científicos de las Matemáticas, la Física y la Química
LAS ONDAS ELECTROMAGNETICAS Y LA ENERGÍA
Las ondas electromagnéticas son campos eléctricos (E) y magnéticos (H) variables, oscilantes y mutuamente perpendiculares que se desplazan por el espacio y se relacionan íntimamente con el concepto de energía

Onda electromagnética
MAGNITUDES Y CUALIDADES DE LAS ONDAS
A = Amplitud de la onda (La mayor oscilación respecto de la posición de equilibrio)
c = velocidad de propagación de la onda ( cm/ seg)
= longitud de onda ( lambda) desplazamiento del frente de onda en un ciclo (cm)
T = Período ( tiempo de un ciclo ) (seg)
= frecuencia ( nu ) = 1/T seg –1 = ciclos/seg = Hertz
Ecuación fundamental = c T
El fenómeno de la difracción de las ondas es una clara manifestación de la propiedad de interferencia de las ondas. Los ribetes de claridad y oscuridad que acompañan la sombra de los bordes de la hoja de afeitar son consecuencia del fenómeno de la difracción y prueban la naturaleza ondulatoria de la luz.

Difracción de la luz
EL ESPECTRO CONTINUO DE ONDAS ELECTROMAGNÉTICAS
Al incidirlas ondas electromagnéticas sobre un prisma es posible separar las componentes según sus distintas frecuencias.

FÍSICA MODERNA
LA ENERGÍA ES DE CARACTER DISCONTÍNUO
SE PRESENTA A LA FORMA DE PEQUEÑOS
"PAQUETES DE ENERGÍA "
QUE SE DENOMINAN CUANTOS, CUANTAS O FOTONES
LA ENERGÍA DE UNA ONDA ELECTROMAGNÉTICA ES PROPORCIONAL A SU FRECUENCIA
ECUACIÓN DE MAX PLANCK
ENERGÍA DE UN FOTÓN = h v
h = Constante de Planck = 6,62 10 -27 erg. seg
Energía asociada a los cambios de órbita

LA MECANICA CUANTICA ONDULATORIA
Efecto Compton

DUALISMO ONDA-PARTÍCULA
FOTÓN = ONDA ==> EFECTO COMPTON ==> PARTÍCULA
ELECTRÓN PARTÍCULA = DIFRACCIÓN DE ELECTRONES (1927) ==> ONDA
DE BROGLIE
" Todo cuerpo en movimiento tiene una onda asociada"
λ = h / m x v = h / p

Electrón, partícula – onda estacionaria
PRINCIPIO DE INCERTIDUMBRE DE HEISSENBERG

Es imposible conocer simultáneamente la posición x y el momento p de un electrón
D x D p = l . h / l = h > 0
LOS NUMEROS CUANTICOS, SU SIGNIFICADO,
SUS VALORES Y REGLAS DE COMBINACIÓN
n = Número cuántico principal.
Se asocia al tamaño y energia de los orbitales
¿Cuántos valores? infinito
¿Cuáles? 1,2 3,4,..............a ( Es el mismo n del átomo de Bohr)
l = Número cuántico secundario
Se asocia al tipo o forma de los orbitales
¿Cuántos valores? n
¿Cuáles? 0, 1, 2, 3,
.........(n-1)
s p d f
Cada uno de los cuatro primeros valores se asocian respectivamente a las letras que se indican.
m = Numero cuántico magnético.
Se asocia con la orientación espacial de los orbitales
¿Cuántos valores? 2l +1
¿Cuáles? - l, - ( l-1 ), .... -1, 0, 1, ......+ ( l-1 ), + l
s = Numero cuántico de spín electrónico.
Se asocia al giro del electrón sobre su eje
¿Cuántos valores? 2
¿Cuáles? - 1 / 2 , + 1 / 2
COMBINACIONES DE NUMEROS CUANTICOS Y LOS ORBITALES
n l m nl Número de Orbitales
GRÁFICOS DE ORBITALES


Los orbitales px , py y pz

Los 5 orbitales d

Los 7 orbitales f

ATOMOS POLIELECTRÓNICOS
Ante la imposibilidad de resolver la ecuación de Schorodinger para sistemas de varios electrones, se ha supuesto y con éxito, que sucesivos electrones adoptarán los diversos modos de vibración que se encontraron para el electrón de átomo de Hidrógeno.
Los electrones se ubican primero en los orbitales de menor energía.

GRAFICO RESUMEN

Diagrama para llenado electrónico, orbitales disponibles y en orden de energía creciente
CONFIGURACIONES ELECTRÓNICAS Y ELECTRONES DE VALENCIA

Los electrones de valencia son aquellos que se encuentran en los orbitales de mayor número cuántico principal más aquellos que están en orbitales con el número cuántico principal anterior al mayor a condición de estar incompletos
4ª UNIDAD - PROPIEDADES PERIODICAS DE LOS ELEMENTOS
CUADRO PERIÓDICO


PROPIEDADES PERIODICAS DE LOS ELEMENTOS
La repetición de las configuraciones electrónicas y la consiguiente conformación de un sistema de períodos y grupos es el fenómeno de carácter periódico más relevante. Sin embargo, hay otras propiedades atómicas importantes afectadas de carácter periódico.
El RADIO ATOMICO (R.A.)
Es la distancia entre el núcleo del átomo y el electrón periférico.
El siguiente gráfico muestra elocuentemente la variación periódica del Radio Atómico al avanzar el N
mro Atómico en los elementos. Se observa que los picks de mayor Radio Atómico corresponde a los metales alcalinos.
Diagrama de radios atómicos y radios iónicos

tomado del Merrill Química (Smoot,Price,Smith pág 183 )
Las estructuras isoelectrónicas, son iones positivos o negativos o bien átomos neutros que poseen igual configuración electrónica ( igual número de electrones ). Puede pensarse, que
por ésta razón, el Radio de las estructuras isoelectrónicas debe ser el mismo. No es así, pues, al igual que acontece con la disminución de los radios en un Período, la carga positiva en el nucleo es diferente. A mayor Z menor Radio.
EL POTENCIAL DE IONIZACIÓN ( P . I .)
Es la Energía que se necesita para arrancar el electrón periférico a un átomo neutro libre.
A 0 (g) + POTENCIAL DE IONIZACIÓN = A+ 1 (g) + e-
Mientras más cercano al nucleo, el electrón periférico es atraído con mayor fuerza y viciversa. En consecuencia la magnitud de la Energía de Ionización se comporta en forma inversa a la del Radio Atómico.
LA ELECTROAFINIDAD ( E . A .)
Es la Energía que se libera cuando un átomo libre y neutro capta un electrón .
A 0 (g) + e- = A-1 (g) + ELECTROAFINIDAD
Mientras más cercano al nucleo, el electrón periférico es atraído con mayor fuerza y viciversa. En consecuencia la magnitud de la Electroafinidad se comporta en forma inversa a la del Radio Atómico .
No cuenta para los gases nobles
LA ELECTRONEGATIVIDAD ( E. N.)
La Electronegatividad es una magnitud que engloba tanto al P.I como a la E.A. y, en consecuencia, es proporcional a ambas. De la misma forma que las magnitudes anteriores se comporta en forma inversa al Radio Atómico
Mide la tendencia a formar iones negativos o bien la capacidad de atraer electrones.
La electronegatividad máxima es la del Fluor e igual a 4. No cuenta para los gases nobles.
LA ELECTROPOSITIVIDAD ( E . P .)
La Electropositividad es una magnitud de sentido inverso de la E. N.
Mide la tendencia a formar iones positivos o bien la capacidad de perder, ceder o repeler electrones.
Tampoco cuenta para los gases nobles
TIPOS DE COMPUESTOS FUNDAMENTALES
-OXIDOS METALICOS
-OXIDOS NO METALICOS
-LOS HIDRÓXIDOS (OXIDO METALICO+ AGUA)
-LOS OXACIDOS ( OXIDO NO METALICO + AGUA)
-LOS HIDRACIDOS (HIDROGENO +NO METALES)
-LAS SALES ( RESULTADO DE LA REACCION DE ACIDOS + BASES)
-LOS HIDRUROS ( IONES METALICOS CON IONES HIDRUROS)
5ª-UNIDAD-EL ENLACE QUIMICO
El enlace químico es la fuerza que une a los atomos para formar las moléculas.
Como ya se ha dicho es un proceso de estabilización por interacciones electrónicas donde cada átomo trata de alcanzar la configuración electrónica del gas noble más cercano. Por lo general los gases nobles tienen 8 electrones de valencia, de allí se acostumbra a decir que el enlace químico se forma cumpliendo la "regla del octeto".
Los electrones de valencia son aquellos que se encuentran en los orbitales de mayor número cuántico principal más aquellos que están en orbitales con el número cuántico principal anterior al mayor a condición de estar incompletos.

TIPOS DE ENLACES Y POLARIDAD DE LOS ENLACES
Existen dos mecanismos para cumplir la regla del octeto.
a. ENLACE IONICO. Cesión de electrones, de parte de un átomo fuertemente electropositivo a otro fuertemente electronegativo. Formación de iones positivos y negativos y atracción electrostática entre ellos.
b. ENLACE COVALENTE. Compartición de parejas de electrones entre átomos de parecida o igual electronegatividad. Electrones compartidos con spines opuestos y atracción magnética.
Ejemplos de estas situaciones, donde se muestra la estructura electrónica a nivel molecular, se dan a continuación mediante las correspondientes notaciones de Lewis.

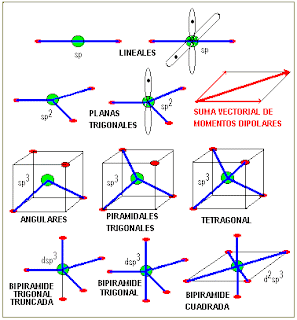
GEOMETRÍA MOLECULAR
La disposición de los átomos en el espacio se determina experimentalmente mediante la técnica de difracción de rayos X. Para hacer concordar la información experimental con aspectos teóricos se ha visto la necesidad de formular un modelo de reordenamiento posicional de los orbitales atómicos. Esta formulación de orden matemático se conoce como hibridación de los orbitales atómicos (mezcla matemática de funciones de onda).
Existen diferentes formas de hibridación y la forma que en definitiva adopte un átomo decidirá la orientación espacial de sus orbitales y por consecuencia la GEOMETRIA MOLECULAR .
6ª UNIDAD - PROPIEDADES FISICOQUIMICAS
DE LAS SUSTANCIAS PURAS
Los tipos de enlaces, la direccionalidad de éstos, los rasgos eléctricos y otras características moleculares determinan las propiedades fisicoquímicas de las sustancias.
Parece conveniente referirse en éste momento a la fortaleza comparada de los distintos tipos de enlaces interatómicos. La fortaleza del enlace está dada por la energía necesaria para romper el enlace y ésta a su vez es directamente proporcional a la energía de estabilización o energía liberada cuando el enlace se forma.
El enlace covalente es el más fuerte, lo sigue el iónico y finalmente el metálico que es el más débil.

A continuación trataremos de visualizar las distintas categorías de sustancias y sus propiedades fisicoquímicas principales.
MOLECULAS GIGANTES
Son arreglos de átomos, unidos mediante fuerzas de enlace químico (interatómico), en que no está definido el tamaño del sistema. Por lo general son arreglos de gran tamaño y de allí el nombre de la categoría. La proporción de distintos átomos se conoce y se representan estos sistemas por su fórmula empírica. La fórmula verdadera es (F.E.) n , pero n es indeterminada.
Hay tres grandes tipos de moléculas gigantes, las de enlace iónico, las de enlace covalente y las de enlace metálico.
ENLCE COVALENTES
COVALENTES TRIDIMENSIONALES
Son arreglos tridimensionales de átomos iguales o diferentes unidos por enlaces covalentes y dispuestos en el espacio siguiendo las reglas de la hibridación. Son las estructuras más rígidas, duras o resistentes que se conocen.
Sus temperaturas de fusión son muy altas ( miles de°C) y en muchos casos se descomponen químicamente por el calor antes de entrar en fusión. Por otra parte la separación de las partículas por acción de moléculas de un solvente es imposible, por lo tanto son completamente insolubles.
El Carbono en su forma de diamante ( hibridación sp3 ) es un ejemplo típico de ésta categoría. Las láminas de Silicio de la nariz del Discovery son otro ejemplo.

COVALENTES BIDIMENSIONALES
Es cuando la red de enlaces covalentes se teje en dos dimensiones. Los mismos conceptos de infusibilidad e insolubilidad que para las mallas trididimensionales pero no así en lo que se refiere a la dureza pues las fuerzas de atracción entre las mallas bidimensionales es débil. Por esa razón estas sustancias son blandas en el sentido del desprendimiento de las mallas.
El ejemplo típico es el Carbono en su forma de grafito en que los C están hibridizados sp2 . Es interesante consignar que en cada orbital pz existen un electrón. Estos electrones se pueden desplazar sobre la malla y en consecuencia el grafito es conductor de la corriente eléctrica.

COVALENTES UNIDIMENSIONALES
Corresponde a las sustancias denominadas polímeros, largas cadenas de unidades conectadas por enlaces covalentes.
Son cadenas largas llamadas también macromoléculas y por ésta razón es que interaccionan unas con otras de manera significativa. Las interacciones entre macromoléculas son fuerzas de distintos tipos .
ENLACE IONICAS.
En estas moléculas gigantes los átomos están unidos por enlaces iónicos. Es decir son un arreglo de iones positivos y negativos que se disponen alternadamente en el espacio compensando sus cargas . La geometría del arreglo es simple cuando los iones positivos y negativos son monoatómicos y además se encuentran en relación 1:1 como en el caso del Na+Cl -. Cuando los iones son complejos, con grandes diferencias de tamaños o la proporción entre ellos no es simple, los arreglos son complicados y son materia de estudio de la Cristalografía que hace uso de las técnicas de difracción de rayos X para resolver estas situaciones.

Son estructuras de temperatura de fusión elevadas , alrededor de los 1000°C de acuerdo a la fortaleza del enlace iónico. En estado sólido o cristalino, donde los iones se encuentran atrapados no conduce la corriente eléctrica, pero sí la conducen en estado fundido.
ENLACE METALICAS
Corresponde al caso de los metales. Los átomos metálicos , al ser muy electropositivos se desprenden de sus electrones de valencia pasando a formar iones positivos. Por su parte los electrones que han perdido su pertenencia a un átomo determinado se mueven entre los iones constituyendo una nube de electrones delocalizados. Esta nube de electrones que une a iones positivos es el enlace metálico.

Ya nos hemos referido a la fortaleza del enlace metálico y podemos generalizar diciendo que los puntos de fusión de los metales son medianamente altos. Señalemos que metales como el Hg, Cs, y Fr son líquidos a temperatura ambiente.
7ª UNIDAD - EL CONCEPTO DE MOL Y SUS APLICACIONES
¿ Qué cantidad de átomos del elemento hay en el Peso Atómico del elemento expresado en gramos?
Daremos la respuesta más simple, en base a un experimento también simple esquematizado en el siguiente gráfico.

Colectamos 4,0026 gr. de Helio y leemos en el contador la cantidad de núcleos detectados y luego transformados en átomos. Hemos colectado 6,023. 10 23 átomos de Helio. Esta es la respuesta, válida para todos los elementos, a la pregunta formulada:
En el Peso Atómico de un elemento expresado en gramos existen 6,023 .10 23 átomos del Elemento.
Si pesaramos en la balanza de una confitería 51 de gramos de virutas de vanadio metálico estaríamos pesando aproximádamente 6,023 10 23 átomos de vanadio puesto que el Peso Atómico de ese metal se ha determinado como igual a 50,94.
El valor 6,023 1023 fué determinado por Avogadro mediante cálculos estadísticos acerca de sistemas gaseosos y de ahí que se reconoce como el Número de Avogadro ( N ).
N = 6,023 .10 23
Este valor pasa a ser de importancia central en la química cuantitativa y es la base de la definición del concepto de mol
DEFINICIÓN DE MOL
Un Mol es 6,023 10 23 unidades.
Así el mol pasa a ser una forma adecuada de medir cantidades de partículas de la química, como recién lo dijimos, podemos medir cómodamente un mol de átomos de Vanadio o un mol de átomos de cualquier otro elemento en la balanza de una confitería.
Pero el Número de Avogadro de átomos es una cantidad tan grande de átomos o bién los átomos son tan pequeños y livianos que son magnitudes que desafían nuestra imaginación. Según nos hizo notar recientemente un colega, si tuvieramos una hilera de 1 mol de hormigas de 1mm cada una separadas cada una de la precedente por una distancia también de 1mm, la longitud de la hilera cubriría 1,2046 10 18 Km. Tal hilera cubriría mil doscientos setenta y ocho millones de veces la trayectoria circular de la Tierra alrededor del Sol.
EL MOL DE MOLECULAS
Volvamos a nuestra experiencia de recolección de Helio puesto que podemos sacar mucho más provecho de ella y coloquemos a nuestro sistema en situación comparativa con otros.

DEFINICIÓN DE PESO MOLECULAR
El Peso Molecular ( M r ) de una sustancia es la masa de un mol de moléculas de tal sustancia expresada en gramos.
Sus unidades de medidas serán por consiguiente gramos / Mol de moléculas
Observamos en las representaciones gráficas de este caso que, a nivel submicroscópico una molécula está formada por dos átomos y que a nivel macroscópico (ampliación) un mol de moléculas está formado por dos moles de átomos.

CALCULO DEL PESO MOLECULAR
Generalizando, si una Sustancia tiene por Fórmula AaBbCc........
A nivel submicroscópico su molécula está formada por a átomos de A, b átomos de B y c átomos de C etc...
y a nivel macroscópico el mol de moléculas está formada por a moles de átomos de A, b moles de átomos de B y c moles de átomos átomos de C etc... y de allí que el Peso Molecular se calcule con la siguiente fórmula.
Mr AaBbCc........ = a * Ar A + b * Ar B + c * Ar C +........
¿Cuánto vale el Peso molecular del Cloroformo CHCl3?
Mr CHCl3 = 1 *12 + 1 * 1 + 3 * 35,5 = 119,5 g/mol
LA ECUACIÓN DE ESTADO DE LOS GASES IDEALES.
Para dar adecuada respuesta a la pregunta planteada es necesario averiguar las relaciones matemáticas que expresan el comportamiento de las distintas variables que determinan el estado de un sistema gaseoso. Un sistema gaseoso se encuentra en un estado definido cuando, además de precisarse la naturaleza del gas, se conocen tres de las siguientes cuatro variables:
n = Número de moles, V = Volumen l , P = Presión en atm t = temperatura °K
Para comenzar el estudio de las relaciones es conveniente definir el Volumen Molar
R =0,082 (L atm / mol °K)
-ecuacion de los gases ideales
PV=nTR
MÉTODO DE DETERMINACIÓN DEL PESO MOLECULAR
La determinación experimental del valor de Mr es de fundamental importancia cuando no se conoce la fórmula de alguna sustancia. Si la sustancia se puede evaporar podemos aplicar la ecuación anterior pero para calcular el Peso Molecular.
Mr = densidad de p,t * RT / P
8ª- UNIDAD SOLUCIONES
Al comienzo del curso señalamos que las soluciones son sistemas homogéneos( por lo tanto son una sóla fase), formado por mezclas de diferentes sustancias puras ( diferentes tipos de moléculas). También vimos que éstas mezclas homogéneas pueden ser sólidas, líquidas o gaseosas.
Estos sistemas tienen una importante presencia, tanto en sistemas de materia viviente como en materia inerte y en muchos sistemas de interés técnico. Pueden ser muy complejos cuando el número de diferentes sustancias mezcladas es muy elevado o bién simples como ternarios( 3 ) y binarios (2).
Las sustancias presentes en sistemas simples se denominan:
Soluto : Componente (s) que se encuentra (n) , comparativamente, en menor proporción y
Solvente : Componente que se encuentra, comparativamente en mayor proporción.
Sin embargo, cuando una sustancia originalmente sólida es disuelta en líquido es el soluto y el líquido es el solvente.
Similarmente, cuando una sustancia originalmente gas es disuelta en líquido es el soluto y el líquido es el solvente.
Sistemas Saturados
Las limitaciones aparecen con mucha claridad cuando se mezclan sustancia originalmente sólida o bién originalmente gas con líquidos. Estas situaciones límites se analizan fundamentalmente usando el concepto de solubilidad y que ahora parece oportuno volver a recordar.
La solubilidad es la mayor cantidad de soluto, que en forma estable, puede disolverse (mezclarse) en una determinada cantidad de solvente bajo condiciones determinadas de Presión y Temperatura.
Un sistema tiene la cantidad de soluto disuelta correspondiente a la solubilidad cuando no se puede disolver en mayor cantidad aún cuando haya la sustancia en su forma original en contacto con el solvente. En estas condiciones la solución está saturada, y además hay un equilibrio entre la Sustancia original y la Sustancia disuelta. Para que una solución se considere saturada basta que la cantidad de soluto disuelto corresponda a la solubilidad haya o no tal equilibrio..
LA CONCENTRACION DE LAS SOLUCIONES
La forma usada para caracterizar una solución, luego de especificar el soluto y el solvente, es establecer la relación entre las cantidades de ellos. Esta relación es la Concentración, que implica un cuociente entre una cantidad de soluto y una cantidad de solución, o bien de solvente. Nuevamente por ser la concentración un cuociente entre magnitudes Extensivas es una magnitud Intensiva. Se comprende el caracter intensivo de la concentración, es decir el de una magnitud propia de la solución e independiente de la cantidad de la solución, si pensamos en una bebida de fantasía que tiene siempre las mismas características (color, sabor, concentración), no importando si se adquiere en tamaño individual, mediano o familiar. De lo dicho se infiere que la concentración las soluciones es un concepto de vastísima aplicación ligado al estudio de múltiples sistemas y procesos productivos.

Existen varias formas de expresar la concentración, las mostraremos en el gráfico siguiente, indicando las ecuaciónes que las definen y mostrando un ejemplo de su cálculo con los datos del sistema ya entregados:

Ejemplo:

PREPARACIÓN DE UNA SOLUCIÓN A PARTIR DE OTRA SOLUCIÓN CONCENTRADA
A modo de ejemplo de lo que se preconiza se presenta la siguiente situación problemática de preparación de una solución a partir de una solución concentrada ( la misma solución con que se trabajó en el primer problema de conversión de unidades).

Unidad
MAGNITUDES FUNDAMENTALES DEL CAMBIO QUIMICO
CONDICIÓN DE ESTEQUIOMETRÍA
Observar: -Dn N2 / 1 = -Dn H2 / 3 = +Dn NH3 / 2 = X

La razón de transformación X = Dn / Coeficiente Estequiométrico, es también asociada a la coordenada de avance de la reacción, en este caso, el avance es lineal e igual en relación al tiempo puesto que hemos señalado que " reacciona 1 mol de N2 por cada unidad de tiempo transcurrido ". Sin embargo la relación puede ser de otro tipo (una curva de cualquier tipo) y está relacionada con el concepto de velocidad de la reacción.
NOTA:
EN LOS GRÁFICOS LA COORDENADA DE AVANCE DE REACCIÓN X SE SEÑALA COMO R.

Se observa que la relación entre los nt y X es de tipo lineal, es decir, corresponde a lineas rectas.
De la condiciónde estequiometría deducimos las correspondientes ecuaciones para los diferentes nt
-( nt N2 - ni N2) / 1 = -(nt H2 - ni H2) / 3 =+ (nt NH3 - ni NH3) / 2=X
nt N2 = ni N2 - 1 * X
nt H2 = ni H2 - 3 * X
nt NH3 = ni NH3 + 2 * X
Observar el signo, según se trate de un reactivo o de un producto)
y que para este ejemplo en particular:
nt N2 = 7 - 1 * X
nt H2 = 15 - 3 * X
nt NH3 = 3 + 2 * X
En lo general:

*CALCULOS ESTEQUIOMETRICOS
Se refieren a la determinación de las cantidades de Sustancias ( A,B,C y D ) involucradas en una determinada reacción química.
Sea a A + b B = c C + d D la ecuación de la reacción general, donde a,b,c y d son los respectivos Coeficientes Estequiométricos.
Sean niA , niB ,niC , niD la cantidad de moles de los reactivos y productos en el instante inicial de la reacción (tiempo = 0)
Sean ntA , ntB ,ntC , ntD la cantidad de moles de los reactivos y productos en el instante t desde el momento inicial de la reacción ( tiempo = t )
Transcurrido el tiempo t, cada una de las sustancias ha variado como consecuencia de la reacción, ya sea desapareciendo (Reactivos) o bién apareciendo (Productos) en las siguientes cantidades.
D nA = ntA - niA ; D nB = ntB - niB ; D nC = ntC - niC ; D nD = ntD - niD
Debe notarse que D nA = ntA - niA y D nB = ntB - niB son negativos, porque en el instante t hay menos moles de A y B que al comienzo( porque los reactivos se consumen)
Debe notarse que D nC = ntC - niC y D nD = ntD - niD son positivos, porque en el instante t hay más moles de C y D que al comienzo( porque los productos se originan o aparecen)
LA VALORACIÓN O TITULACIÓN
El análisis químico cuantitativo determina las cantidades de sustancia presentes en distintos sistemas. Lo hace con técnicas de gravimetría, o sea el uso de métodos basados en pesar sustancias en balanzas de precisión. Con técnicas de volumetría, métodos basado en la medición de volumenes de soluciones. Con la espectroscopía, basada en métodos ópticos y electrónicos etc. Las técnicas de la Volumetría descansan fundamentalmente en las denominadas Valoración o Titulación, o sea las que determinan el valor de la concentración o el Título de una solución.
La Titulación o Valoración se basa en una reacción química y por lo tanto habrá tantos tipos de Titulaciones como tipos de reacciones que sirvan a propósitos de cuantificación. Se conocen titulaciones de formación de precipitados, de formación de complejos, de ácidos con bases, de oxido reducción etc.
ESTANDARIZACIÓN DE LA BASE
Haremos la titulación de la solución de NaOH usando ácido oxálico dihidratado, C2O4H2 x 2 H2O, que por presentarse en estado sólido podemos cuantificar fácil, exacta y precisamente pesándolo en una balanza analítica de precisión.
La reacción ácido-base o de neutralización es la siguiente:
C2O4H2 + 2 NaOH = C2O4Na2 + 2 H2O
9ª EQUILIBRIO QUÍMICO.
CARACTERIZACIÓN CUANTITATIVA DEL EQUILIBRIO QUÍMICO

2 H2 + O2 = 2 H2O
t = 0 Situación inicial (i) 2 moles 1 mol 0 mol
Variación en moles = Δ n (r) -2x -x 2x
tf = te Equilibrio (e) 2-2x 1-x 2x
2(1-x)
x es constante e indica la razón de transformación alcanzado el equilibrio y nos orienta de la posición del equilibrio.
Desde un punto de vista sólo conceptual la situación de equilibrio esta bien descrita pero desde un punto de vista práctico o cuantitativo poco significado tiene tal descripción si no se sabe directa o indirectamente el valor de x. Observamos que x está relacionada con las cantidades o concentraciones de las sustancia en equilibrio pero que éstas a su vez , además de x, dependen también de las cantidades o concentraciones iniciales. Tratemos de buscar relaciones de carácter más general.
Ya hemos expresado que, por convención, se acostumbra a analizar la situación de equilibrio arribando a ella desde los reactivos formales y que por otra parte esa situación de equilibrio es el resultado de la igualación en valor absoluto de las velocidades de reacción directa e inversa.

Se observa que a partir del momento inicial y en cada instante, las velocidades directa e inversa varían conforme a lo expresan sus respectivas leyes de velocidad. Esto es, si las reacciones directa e inversa quedan expresadas por la ecuación generalizada siguiente y además son elementales ( Estado Transición de un choque)
a A + b B = c C + d D
velocidad instantánea directa = kd [ A ]a [ B ]b disminuye pues [ A ] y [ B ] disminuyen.
velocidad instantánea inversa = ki [ C ]c [ D ]d aumenta pues [ C ] y [ D ] aumentan.
Estas variaciones cesan cuando las velocidades se igualan en valor absoluto y se alcanza la situación de equilibrio en el instante te. De allí en adelante en el tiempo las velocidades no cambian ni tampoco cambian las concentraciones de las especies involucradas en las reacciones.
velocidad instantánea directa = velocidad instantánea inversa ( a partir de te )

Al plantear el asunto como definición nos alejamos de consideraciones acerca de mecanismos de las reacciones directa o inversa.
Esta constante de equilibrio, K eq, es de carácter más general o intensiva que x pues es igual a una expresión matemática cuociente de concentraciones de equilibrio y no depende de las particularidades extensivas de un sistema en particular. Mejor que x su valor nos indica la posición del equilibrio aunque ambas estén relacionadas.

PRINCIPIO DE LE CHATELIER
"Cuando un sistema que se encuentra en la situación de equilibrio químico es sometido a una modificación (por ejemplo una variación de temperatura, variación de la concentración de una de las especies presentes en el equilibrio, variación de la presión u otra ), busca una nueva posición de equilibrio y al hacerlo contrarresta la modificación"
LOS ACIDOS Y LAS BASES
Ya hemos estudiado varias veces la identidad de los ácidos y las bases y sus reacciones, principalmente las que ocurren en medios acuosos. Repasemos.
Mejor que un nuevo tipo de compuestos habría que señalar que son compuestos que poseen una propiedad relacionada a la reacción de disociación del agua y a los iones que allí son liberados:
H2O
H2O = H + + OH –
ión hidrógeno ión hidroxilo
ACIDOS son sustancias de fórmula general HA que se disocian en agua liberando el ión hidrógeno (Definición de Arrehenius)
BASES son sustancias de fórmula general BOH que se disocian en agua liberando el ión hidroxilo. ( Definición de Arrehenius)
1. Anión es un ión de carga negativa y Catión es un ión de carga positiva. Los nombres provienen de la Electroquímica
Definición de ácidos y bases según Bronsted y Lowry.
Según estos autores: un ácido es una sustancia que cede H+ y
base es una sustancia que capta H+
10 Unidad - REACCIONES DE OXIDO-REDUCCIÓN
Las reacciones de oxido reducción son reacciones de transferencia de electrones.
El siguiente esquema ilustra claramente las consecuencias de tal transferencia de electrones. Se produce una reacción, ilustrada en el sentido directo, dónde las especies modifican su carga eléctrica o Número de Oxidación
OXIDACION: es una pérdida de electrones y la especie que experimenta tal pérdida de electrones aumenta su Número de Oxidación o Carga eléctrica
REDUCCION: es una ganancia de electrones y la especie que experimenta tal ganancia de electrones disminuye su Número de Oxidación o Carga eléctrica
Cada uno de los esquemas muestra la semirreacción que lo representa.
Si las semirreacciones se suman, esto es, 1) se reunen los términos de las ramas izquierdas y se igualan a los términos de las ramas derechas y 2) se cancelan los términos iguales o repetidos a ambos lados de la igualdad. La reacción resultante es la global, la reacción de oxido-reducción o redox.
A0 = A+ + e- Semirreacción de oxidación
B0 + e- = B- Semirreacción de reducción
______________________________________
A0 + B0 + e- = A+ + e- + B-
A0 + B0 = A+ + B-
Toda semirreacción correctamente escrita presenta el correcto......
a) BALANCE DE MASA ( Ecuación equilibrada, número y tipo de átomos de la izquierda debe ser igual al número y tipo de átomos de la derecha.)
b) BALANCE DE CARGA ( Carga eléctrica total de la izquierda igual a la carga eléctrica total de la derecha )
Ejercicios
Reconozcamos las reacciones redox entre las siguientes reacciones. En caso de ser redox escribamos las semirreacciones y la ecuación de la reacción redox global equilibrada.
a) Cu + Cl2 = CuCl2
b) Al2 (SO4) 3 = 2Al+3 + 3 SO4 –2
c) Na + CH3OH = CH3ONa + H2
d) C 0 + Fe2 O3 = Fe + CO2
e) Zn + Ag+1 = Zn +2 + Ag
f) Fe Cl2 + K2Cr2O7 + HCl = FeCl3 +CrCl3 + KCl + H2O
a) Las reacciones de oxido reducción se reconocen porque implican la variación de la carga eléctrica. Por esto la asignación correcta de las cargas es fundamental. Para tal asignación correcta la cultura química es promordial. Para aumentar su cultura química sobretodo en temas de asignar números de oxidación heche una miradita al capítulo 4 en relación a las valencias y los compuestos y sus fórmulas.
b) Así asignemos entonces los números de oxidación correctos y si hay variaciones se trata de reacciones oxido- reducción o redox.
c) Enseguida escribamos las semirreacciones de Oxidación y las de Reducción más elementales correspondientes a cada caso. Recordemos el formato de las semirreacciones ( en las oxidaciones los e- suman a la derecha, en las reducciones los e- suman a la izquierda) y observemos que la transferencia de un electrón significa la variación de una unidad de la carga.
d) Transformemos aquellas semirreaciones, mediante las amplificaciones adecuadas, de tal forma que exista el número de atomos necesarios para formar las moléculas de reaccionantes y productos que pide la transformación de partida. Además, las amplificaciones deben ser tales que el numero de electrones cedidos debe ser igual a los captados .
e) Habiendo adecuado las semirreacciones, luego las sumamos y tendremos el esqueleto fundamental y equilibrado en masa y carga de la reacción pedida.
f) A tal ecuación esqueleto le agregamos en ambos miembros los átomos grupos o cargas de tal forma de llegar a la expresión definitiva de la ecuación de la transformación original.
REDUCTORES Y OXIDANTES
Completamos esta visión básica de las reacciones de oxido reducción con los conceptos de reductores y oxidantes, de gran importancia teórica y práctica.

LOS POTENCIALES STANDARD

Comparando los potenciales standard de diferentes electrodos con respecto a un electrodo de Hidrógeno gaseoso suportado sobre Platino en un medio ácido de pH = 0 a 25 °C se establecen las tablas de potenciales standard de oxidación para diferentes semirreacciones. Por tener el Hidrógeno tendencias intermedias respecto de la oxidación o de la reducción ( Recordar el H+ y el H- ) se establece como valor de referencia y convencionalmente se le asigna el valor de 0,000 Voltios.
Los potenciales eléctricos son de índole Intensiva por cuanto dependen de la reacción o del material o sustancia pero no del tamaño o masa de la misma.

En la Tabla el signo y el valor del potencial standard indican la tendencia y fuerza a que las semirreacciones ocurran. Así la tendencia a la oxidación del Na0 es muy alta ( recordaremos la reacción violenta del sodio metálico con agua) en cambio la tendencia a la oxidación del plata Ag0 es muy baja ( se usa como joyas o adornos). Así el Na0 es un reductor poderoso. El Cloro gaseoso es un oxidante poderoso, mirando la tabla, el potencial de oxidación -1,36 Voltios indica que la reacción inversa, es decir la reducción del Cl0 a Cl- es la tendencia predominante.
Dado tal significado para las semirreacciones y sus potenciales es absolutamente comprensible la presentación de las tablas de semirreacciones y potenciales de reducción, que aparecen en alguna literatura.

EL POTENCIAL ELECTRICO ASOCIADO A LAS REACCIONES REDOX
LAS PILAS O CELDAS GALVÁNICAS
Corresponden a reacciones redox cuyo potencial eléctrico es positivo, ΔE0 > 0, es decir reacciones que (en el sentido directo) evolucionan espontáneamente liberando energía química a la forma de energía eléctrica.

LA ELECTROLISIS
Corresponden a reacciones redox cuyo potencial eléctrico es negativo, ΔE0 < 0, es decir, reacciones que (en el sentido directo) no evolucionan espontáneamente y que para forzar su ocurrencia se debe gastar energía electrica.
Es exactamente el proceso inverso o contrario que el de una pila

LA CORROSIÓN DE LOS METALES
La corrosión es en general el deterioro de materiales por acción del medio ambiente. Nos preocuparemos de la corrosión química que afecta principalmente a los metales. Desde luego, los potenciales standard de oxidación indicaran en forma general la tendencia a la corrosión de los diferentes metales. En la práctica hay muchas situaciones especiales como aquella del aluminio que se oxida fácilmente pero que luego la capa de oxido formada, muy compacta, impide posterior corrosión.
FW Trabajo final
"ELECTROLISIS Y SUS UTILIDADES"
Fue descubierto accidentalmente en 1800 por William Nicholson mientras estudiaba el funcionamiento de las baterías. Entre los años 1833 y 1836 el físico y químico inglés Michael Faraday desarrolló las leyes de la electrólisis que llevan su nombre y acuñó los términos.
la electrolisis es reacciones redox cuyo potencial eléctrico es negativo, ΔE0 < 0, esto significa que las reacciones no son espontáneamente y que para forzar su ocurrencia se debe gastar energía electrica externa.
Este proceso se emplea para la obtención de metales y no metales al estado puro, y para hacer recubrimientos protectores (cromados, niquelados, etc.) .

reacion quimica
(electrólisis de una sal fundida de CuCl2)
Anodo (E. positivo) 2 Cl- Cl2° + 2e- E°Oxid = -1,36 Volt
Cátodo (E. negativo) Cu2+ + 2e- Cu° E°red = 0,34 Volt
________________
Reacción neta Cu2+ + 2Cl- Cu° + Cl2o
E° = -1,36 + 0,34 = -1,02 Volt
El E° de la reacción indica el voltaje mínimo requerido para que se realice la electrólisis, luego el voltaje aplicado debe ser igual o superior a 1,02 Voltios.
La electrólisis
Las moléculas de ciertos compuestos químicos, cuando se encuentran en disolución acuosa, presentan la
capacidad de separarse en sus estructuras moleculares más simples en sus átomos constituyentes. Estos
compuestos químicos, que evidencian la propiedad de disociación o ionización en disoluciones, se denominan
electrolitos, y la reacción química de disociación se denomina electrólisis.
Electrolitos
Los electrolitos son sustancias químicas capaces de disociarse o ionizarse cuando se encuentran en
disolución o fundidas. Los electrolitos disociados permiten que el sistema conduzca la corriente eléctrica.
Ejemplo de electrolitos: CaCO3
Iones
Proceso de la electrolisis
* Se aplica una corriente eléctrica contínua mediante un par de electrodos conectados a una fuente de alimentación eléctrica y sumergidos en la disolución. El electrodo conectado al polo negativo se conoce como cátodo, y el conectado al positivo como ánodo.

* Cada electrodo atrae a los iones de carga opuesta. Así, los iones negativos, o aniones, son atraídos y se desplazan hacia el ánodo (electrodo positivo), mientras que los iones positivos, o cationes, son atraídos y se desplazan hacia el cátodo (electrodo negativo).

Animación sobre la Electrolísis del Agua.
* La energía necesaria para separar a los iones e incrementar su concentración en los electrodos es aportada por la fuente de alimentación eléctrica.
* En los electrodos se produce una transferencia de electrones entre éstos y los iones, produciéndose nuevas sustancias. Los iones negativos o aniones ceden electrones al ánodo (+) y los iones positivos o cationes toman electrones del cátodo (-).
En definitiva lo que ocurre es una reacción de oxidación-reducción, donde la fuente de alimentación eléctrica se encarga de aportar la energía necesaria.
Electrólisis del agua
Si el agua no es destilada, la electrólisis no sólo separa el oxígeno y el hidrógeno, sino los demás componentes que estén presentes como sales, metales y algunos otros minerales.
reaccion quimica
2 H2O O2° + 4 H+ + 4e- E° Oxid = -1,23 Volt
2 H2O + 2e- 2 OH- + H2° E° red = -0,83 Volt
Por esta razón es importante controlar el voltaje que se aplica para la electrólisis.
Es importante hacer varias consideraciones:
- Nunca deben unirse los electrodo, ya que la corriente eléctrica no va a conseguir el proceso y la batería se sobrecalentará y quemará.
- Debe utilizarse siempre corriente continua (energía de baterías o de adaptadores de corriente), NUNCA corriente alterna (energía del enchufe de la red).
- La electrólisis debe hacerse de tal manera que los dos gases desprendidos no entren en contacto, de lo contrario producirían una mezcla peligrosamente explosiva .
Aplicaciones de la Electrólisis
* Producción de aluminio, litio, sodio, potasio y magnesio
* Producción de hidrógeno con múltiples usos en la industria: como combustible, en soldaduras.
* La anodización es usada para proteger los metales de la corrosión.
* La galvanoplastia, también usada para evitar la corrosión de metales, crea una película delgada de un metal menos corrosible sobre otro metal.
* recubrimiento protectores en intrumentos kirurgicos para ebitar la oxidadcion y producir infecciones.
*obtener hidrogeno
algunos usos





Obtencion de hidrogeno
La electrólisis del agua es el proceso en el que agua pasa por corrientes eléctricas y sus moléculas se alínean y se separan los átomos de hidrógeno. Fue descubierto en 1820 por el físico y químico inglés Michael Faraday. Consiste en la descomposición mediante una corriente eléctrica de sustancias ionizadas denominadas electrolitos.
Luego de la Electrólisis del agua, el hidrógeno, se congela y puede ser exportarlo.
El problema de la electrolisis del agua a temperatura ambiente había sido su poca eficacia: hasta ahora se requerian 100 watios de electricidad para obtener una cantidad de hidrógeno equivalente a 60 watios. Era rentable este proceso unicamente cuando el precio del barril de petróleo crudo era superior a 40 $, pero ahora ese proceso se ha eficientado mucho más.

HIDROGENO COMO COMBUSTIBLE
Teniendo en cuenta que los beneficios e intereses de la energía alternativa como solución energética van más allá de la reducción de costos únicamente, se presenta además que el mayor uso de estas brindan, la oportunidad de reducir la dependencia con los combustibles fósiles como también de disminuir la contaminación ambiental, debido a que causa un efecto notablemente menor sobre el medio ambiente.
El combustible que se propone como solución es el hidrógeno.
Se ha seleccionado al hidrógeno como el combustible que puede dar solución a dichos problemas debido a:
El hidrógeno cuya base de obtención es el agua, es muy abundante y puede ser utilizado tanto en países energéticamente pobres como en los ricos .
El petróleo crudo y el gas natural son abastecedores de energía limitados.
El hidrógeno puede ser utilizado como recurso energético.
El hidrógeno puede sustituir a los combustibles utilizados actualmente .
Los productos de combustión son considerados no contaminantes o contaminantes en muy bajo grado.
Este es un proyecto de bajos costos y competitivo.
El hidrógeno es una fuente de energía que puede ser almacenada, transmitida y utilizada para las necesidades energéticas del presente y del futuro.
conclusion
la electrolisis es un descubrimiento muy importante ya que por este procedimiento se puede llevar a cabo el proceso de recubrimeinto de proteccion del metal dandole una mejor durabilidad y resistencia al oxido y un mejor aspecto.
Ademas pueden producirse combustible renovable como lo es el (hidrogeno) pero esto todavia no ha sido bien desarrollado ,pero logrando una buena rentabilidad del proceso se podria solucionar el problema de los combustibles no renovables.
la electrolisis ,a ayudado a la tegnologia a alcansado mejores resultado y cada vez llegando mas lejos.
No hay comentarios:
Publicar un comentario